 |
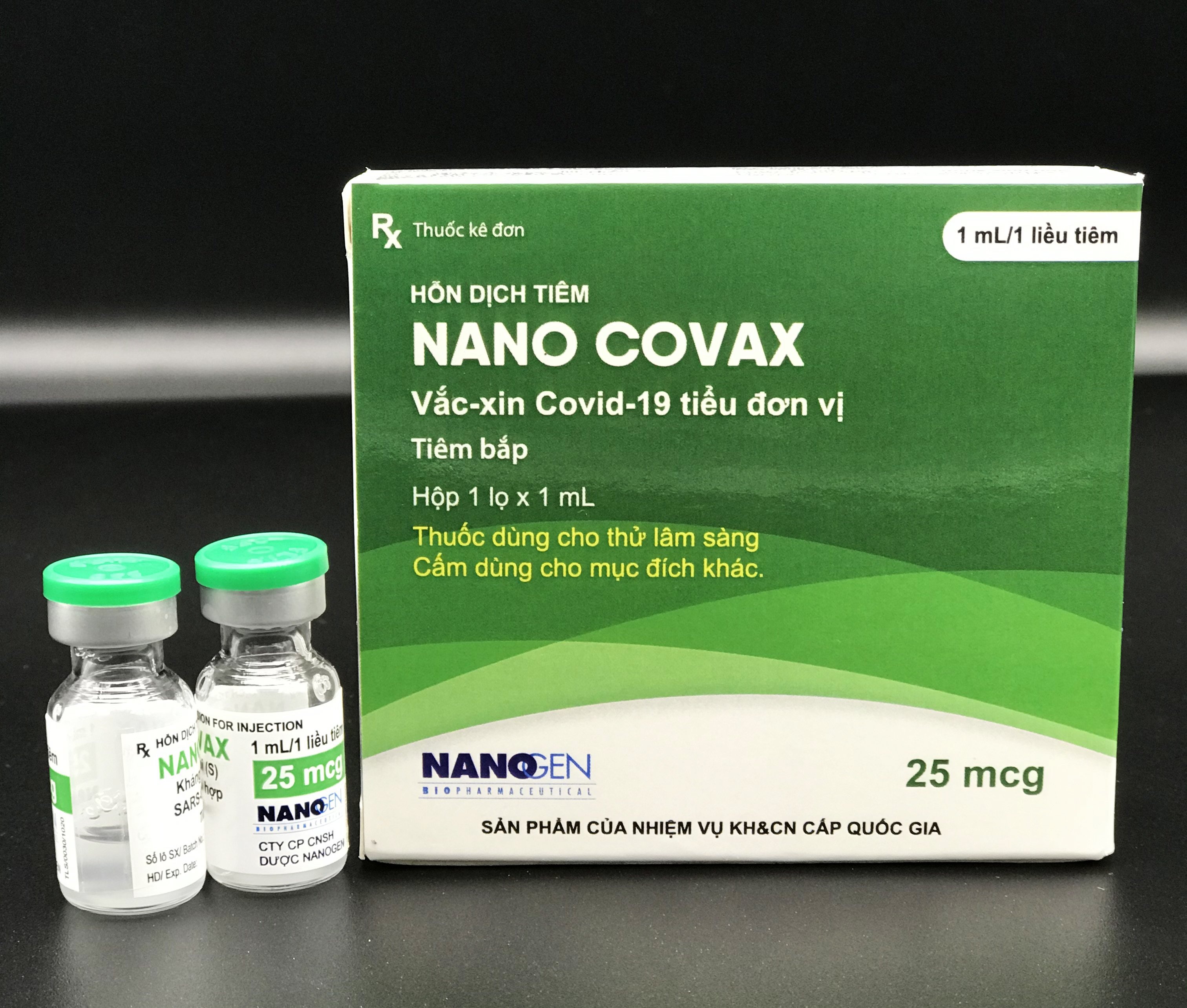
Sau thời gian thử nghiệm lâm sàng trên tổng cộng hơn 14.000 người ở giai đoạn 3, Nano Covax đã được Hội đồng Đạo đức thông qua báo cáo giữa kỳ giai đoạn 3a.
Tối 29/8, Bộ Y tế thông tin Nanogen cần bổ sung hồ sơ để Hội đồng Đạo đức và Hội đồng tư vấn tiếp tục xem xét, thẩm định. Hiện vaccine này chưa được phê duyệt. Song công nghệ sản xuất vaccine Nano Covax đã được chuyển giao cho Ấn Độ và Hàn Quốc.
Phê duyệt và chuyển giao công nghệ là hai quy trình tách biệt
Trên thực tế, việc chuyển giao công nghệ có thể diễn ra trước khi một vaccine Covid-19 được nước sở tại cấp phép. Quá trình chuyển giao công nghệ không phụ thuộc giai đoạn thử nghiệm của vaccine.
Nói cách khác, nó có thể diễn ra vào bất kỳ thời điểm nào, miễn là bên nhận chuyển giao đảm bảo về mặt công nghệ, điều kiện sản xuất. Điều này càng trở nên cấp thiết và được nhiều nước thúc giục các nhà sản xuất vaccine thực hiện nhằm chia sẻ công thức, tăng khả năng tiếp cận.
Theo The Hill, với vaccine mRNA, việc phân phối và sản xuất rộng rãi rất khó khăn do liên quan công nghệ phức tạp và tương đối mới. Tương tự, việc chuyển giao công nghệ vaccine adenovirus đã bất hoạt thông qua con người hoặc vật trung gian rất phức tạp. Các công ty dược phẩm cho hay quá trình chuyển giao cộng nghệ cần được những đơn vị có tiềm lực, đủ điều kiện thực hiện.
Hầu hết vaccine đều cần bảo quản môi trường nghiêm ngặt hay tủ lạnh âm sâu. Với các loại vaccine mRNA, nhiệt độ bảo quản rất quan trọng, cần phương pháp xử lý đặc thù.
Theo công ty tư vấn quản lý toàn cầu McKinsey, thông thường, quá trình chuyển giao công nghệ kéo dài ít nhất 6 tháng. Bên nhận chuyển giao phải có đủ dây chuyền sản xuất vô trùng, cơ sở vật chất hoặc chuẩn bị cho dự án thử nghiệm lâm sàng tiếp nếu có.
Theo Tổ chức Y tế Thế giới (WHO), bên nhận chuyển giao công nghệ có thể thực hiện từng khâu sản xuất (ví dụ đóng ống, gia công như trường hợp của VABIOTECH với vaccine Sputnik V) hay thử nghiệm, điều chỉnh cho phù hợp và cấp phép (Covishield - phiên bản AstraZeneca tại Ấn Độ).
Hay như hãng Pfizer và Sanofi đã thỏa thuận chuyển giao công nghệ, trong đó, Sanofi đóng vai trò gia công các lọ vaccine. Chính phủ Canada thỏa thuận với các doanh nghiệp đơn lẻ và thiết lập nhà máy sản xuất, ký hợp đồng chuyển giao công nghệ để sản xuất vaccine theo dây chuyền của nhà nước.
Hai bên sẽ xem xét, đánh giá tiềm lực và điều kiện sản xuất, quy trình, các vấn đề khác và ký kết bằng biên bản ghi nhớ thỏa thuận hợp tác (MOU). Sau thời gian đánh giá, họ sẽ đi đến ký kết hợp đồng chuyển giao công nghệ chính thức.
Nhà sản xuất của bên nhận chuyển giao công nghệ có thể được đào tạo và nhận giấy phép cần thiết. Đơn vị sở hữu sẽ chuyển giao bí quyết, quy trình kiểm soát chất lượng và các giấy phép cần thiết nhằm đẩy nhanh quá trình sản xuất.
 |
| Covishield là một phiên bản vaccine của AstraZeneca sản xuất tại Ấn Độ dựa trên chuyển giao công nghệ. Ảnh: India Times. |
Trong khi đó, phát triển vaccine là quá trình lâu dài, phức tạp với nhiều giai đoạn, không chỉ với vaccine phòng Covid-19. Theo tài liệu Tổ chức Y tế Thế giới ban hành, quá trình sản xuất vaccine gồm 4 giai đoạn lớn. Thử nghiệm lâm sàng chỉ là một phần nhỏ trong dự án.
Theo Reuters, ngày 12/4/1955, Chính phủ Mỹ đã cấp phép vaccine đầu tiên ngừa bệnh bại liệt ở trẻ em. Ngay lập tức, vaccine này "cháy hàng", bị nâng giá chóng mặt.
Tuy nhiên, ngay sau khi trẻ em được tiêm vaccine, nhiều trường hợp vẫn mắc bệnh. Số ca mắc nhanh chóng lan tăng lên tạo thành một đợt bùng phát dịch bại liệt trên khắp nước Mỹ. Các nhà điều tra xác định vaccine đã bị nhiễm virus bại liệt còn sống từ phòng thí nghiệm Cutter.
Kinh nghiệm xương máu từ quá khứ đã khiến các quy trình phê duyệt tại tất cả quốc gia và tài liệu của WHO đều rất nghiêm ngặt. Việc phê duyệt vaccine được xem xét dựa trên những dữ liệu khoa học và thận trọng. Do đó, quyết định phê duyệt hay không phải căn cứ trên những báo cáo lâm sàng cả 3 pha.
Theo WHO, các giai đoạn để phê duyệt một vaccine gồm:
| Giai đoạn | Nhiệm vụ | Thời gian |
| Giai đoạn I: Phòng thí nghiệm và nghiên cứu trên động vật | - Khám phá: Xác định kháng nguyên tự nhiên có thể ngăn ngừa, điều trị bệnh. - Tiền lâm sàng: Sử dụng hệ thống nuôi cấy mô hoặc tế bào và thử nghiệm trên động vật để đánh giá tính an toàn của vaccine, khả năng tạo ra phản ứng miễn dịch. - Phê duyệt phác đồ lâm sàng: FDA và EMA sẽ phê duyệt phác đồ lâm sàng của vaccine trong 30 ngày | 1 - 2 năm |
| Giai đoạn II: Nghiên cứu lâm sàng trên người | - Giai đoạn một: Giai đoạn này đánh giá trên nhóm 20-80 tình nguyện viên; đánh giá tính sinh miễn dịch - Giai đoạn 2: Mở rộng quy mô người thử nghiệm lên khoảng vài trăm người; kiểm tra tính an toàn - Giai đoạn 3: Số lượng lên tới vài nghìn đến vài chục nghìn người; đánh giá hiệu quả của vaccine | 5 - 10 năm hoặc hơn |
| Giai đoạn III: Phê duyệt, cấp phép và sản xuất | - Nếu đủ điều kiện, loại vaccine này sẽ được phê duyệt và dán nhãn. - Sau đó, FDA hay EMA sẽ tiếp tục giám sát quá trình sản xuất vaccine: Kiểm tra cơ sở sản xuất, xem xét các thử nghiệm về hiệu lực, độ an toàn, sự tinh khiết. | Không quy định |
| Giai đoạn IV: Kiểm soát chất lượng | Chọn ngẫu nhiên các công ty dược phẩm và tiến hành thử nghiệm vaccine sau khi chúng được sản xuất đại trà, bán ra thị trường và kiểm tra tính an toàn, hiệu quả và các tiềm năng khác. | Không quy định |
| Nguồn: WHO, FDA, EMA. | ||
Do tính cấp thiết của đại dịch, vaccine Covid-19 đã được rút ngắn nhiều giai đoạn. Thay vì tốn 5-10 năm hoặc hơn, nhiều vaccine như Pfizer, AstraZeneca, Sputnik V hay Moderna mất 1-2 năm. Nguyên nhân là nhà sản xuất dựa trên các công thức đã có sẵn để phát triển, giảm bớt thời gian nghiên cứu.
Nhiều vaccine được đặt hàng, đề nghị chuyển giao trước khi được phê duyệt
Tại Việt Nam, vaccine ARCT-154 là ví dụ điển hình. Đây là vaccine Covid-19 ứng dụng công nghệ mRNA (tương tự Pfizer, Moderna) - công nghệ tân tiến nhất hiện nay - saRNA (self-amplifying mRNA - mRNA tự nhân bản), do Công ty Arcturus Therapeutics, Inc, Mỹ, phát triển.
Công ty Arcturus đã và đang được thử nghiệm lâm sàng giai đoạn 1, 2 và 3 tại Mỹ, Singapore và nhiều nước khác trên thế giới. Kết quả nhận được rất khả quan.
Khi về Việt Nam, ARCT-154 vẫn thử nghiệm lâm sàng giai đoạn 3 trên quy mô 20.000 người. Trên thực tế, vaccine này vẫn chưa được Mỹ cấp phép lưu hành. Dữ liệu thu được từ các thử nghiệm lâm sàng giai đoạn 3 ở Mỹ, Singapore và nhiều nước khác trên thế giới sẽ là cơ sở trong hồ sơ xin cấp phép tại quốc gia này của ARCT-154.
Theo New York Times, Singapore đã chi 175 triệu USD để mua vaccine trên ngay khi chúng được phê duyệt.
 |
| Dây chuyền lắp ráp ống tiêm tại một nhà máy dược phẩm ở Pháp. Ảnh: NY Times. |
Việc chuyển giao công nghệ hay đặt mua trước không chỉ xuất hiện ở vaccine mà ngay cả các thuốc tiềm năng, nhất là trong bối cảnh Covid-19 vẫn diễn biến phức tạp.
Molnupiravir là một ví dụ. Loại thuốc tiềm năng này đang thử nghiệm lâm sàng giai đoạn 3, chưa được cấp phép. Tuy nhiên, chính phủ Mỹ đã chi khoảng 1,2 tỷ USD để mua 1,7 triệu liệu trình thuốc điều trị cho các bệnh nhân Covid-19. Tại Australia, Cơ quan quản lý hàng hóa trị liệu (TGA) đã cấp quyết định tạm thời cho Molnupiravir trong điều trị Covid-19 từ ngày 10/8.
Do tính khan hiếm và cấp bách của đại dịch, việc chuyển giao công nghệ hay đặt mua trước các sản phẩm dược liệu phòng, hỗ trợ, điều trị Covid-19 không phải điều xa lạ. Nhiều quốc gia, tổ chức cũng thúc giục Mỹ, Nga, chia sẻ công thức điều chế vaccine Covid-19 nhằm chuyển giao công nghệ cho những nước chậm tiếp cận nguồn cung ứng.
Ngày 8/8, Đại sứ quán Ấn Độ được Công ty Nanogen ủy quyền và ký kết thỏa thuận bảo mật bàn giao công nghệ sản xuất vaccine Nano Covax cho Tập đoàn Dược phẩm Vekaria. Hai bên thống nhất Nanogen sẽ chuyển giao công nghệ sản xuất Nano Covax ngay sau khi vaccine được phê duyệt kết quả lâm sàng pha 3.
Nanogen sẽ chuyển giao toàn bộ công nghệ sản xuất, cử chuyên gia Nanogen sang hỗ trợ sản xuất các lô đầu tiên. Song song đó, công ty này tiến hành tổng hợp kết quả nghiên cứu lâm sàng pha 3 để báo cáo theo đúng quy định của Bộ Y tế.
Ngày 20/8, theo tờ The Korean Times, Công ty HLB Pharma Ceutical sẽ chuyển giao và sản xuất vaccine Nano Covax, đồng thời triển khai các chiến dịch quảng bá sản phẩm này trên toàn cầu. Trong thông cáo báo chí của Công ty HLB PharmaCeutical, Chủ tịch Jin Yang-gon cho hay "vaccine đã chứng minh hiệu quả và độ an toàn cao".
Đồng thời, hai bên có thể kết thúc đàm phán sau khi các nhà khoa học đại diện của mỗi công ty xem xét xong dữ liệu lâm sàng trong 3 tháng tới.
Dịch Covid-19
Phát hiện mới về hậu quả của Covid-19
Nghiên cứu mới cho thấy Covid-19 gây hại cho hệ vi sinh vật đường ruột, có thể dẫn đến các vấn đề sức khỏe khác như đầy hơi và trào ngược axit.
Covid-19 vẫn gây chết người nhưng đã thay đổi về nhân khẩu học
Bang California, Mỹ, đang có sự thay đổi về nhân khẩu học trong số ca tử vong. Theo các chuyên gia, xu hướng này tương tự với toàn nước Mỹ và nhiều nước khác trên thế giới.
Phát hiện virus bí ẩn giống SARS-CoV-2 ở Nga
Với protein gai có thể dễ dàng bám vào tế bào người như nCoV, loại virus này khiến các nhà khoa học lo lắng. Đặc biệt, vaccine và kháng thể Covid-19 không có tác dụng với nó.
Đại dịch mới ở những người khỏi Covid-19
Nghiên cứu mới cho thấy ngay cả người nhiễm nCoV nhẹ cũng có nguy cơ bị đau tim, đột quỵ cao hơn. Điều này dấy lên mối lo về đại dịch bệnh tim mạch ở những người khỏi Covid-19.
Triệu chứng nhiễm biến chủng BA.5
Về cơ bản, người nhiễm BA.5 sẽ có các triệu chứng như những chủng Covid-19 trước đó. Song, tần suất gặp phải của từng triệu chứng lại khác nhau.